
流式細胞儀是現代生物學、生物醫學、腫瘤學、血液學、免疫學、藥理學與臨床研究等領域中,不可或缺的利器。流式細胞儀上樣簡單、快速,可檢驗的方式多元,成為分生實驗中常用的檢驗方法。尤其是目前最流行的"幹細胞"研究,幹細胞研究最重要的就是要知道幹細胞分化後,是不是成為我們需要的細胞種類,這時候,流式細胞儀就是個篩選細胞的最佳利器,不僅可以定性也可以定量,某些機型的流式細胞儀甚至可以收集分選出細胞,提高細胞的純度。
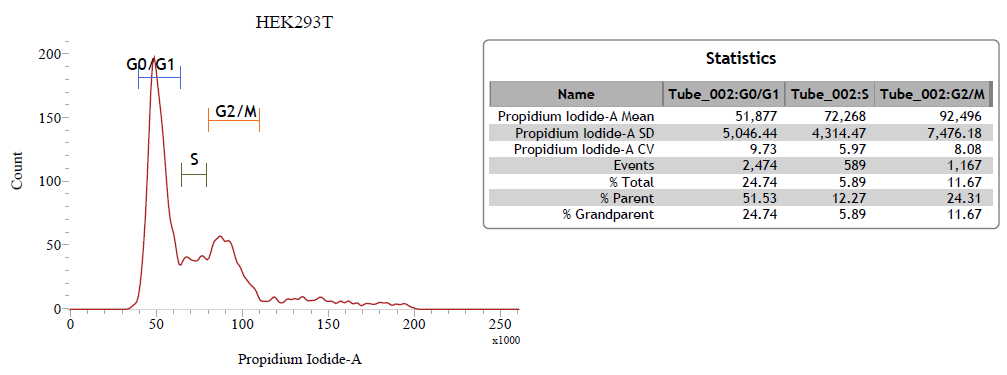
流式細胞技術應用在細胞週期進行時,DNA含量會隨著細胞進入不同周期而有增減,利用螢光對細胞進行相對 DNA 含量測定,可以分析細胞各個週期的百分比。利用核染劑—propidium iodide (PI) 觀測 DNA 含量的變化,藉此偵測細胞週期變化。PI 可標定核酸,無論是 RNA或是 DNA 都會被標記,因此,使用 PI 染劑時需要搭配RNase 消除被 PI 標記到的 RNA。PI 染劑可以透過 488 nm的雷射光激發,激發/發散光約為 495/639 A。
細胞週期分析服務流程
|
流程 |
項目 |
內容 |
|
材料準備 |
確認樣本細胞完整性 |
|
|
PI染色 |
細胞穿孔後以PI染色細胞核 |
|
|
Cell Cycle分析 |
以流式細胞儀分析樣本之細胞週期 |
提供三種圖譜與細胞週期中各個週期的細胞百分比:
|
細胞週期分析圖譜範例
1. FSC vs SSC點狀圖
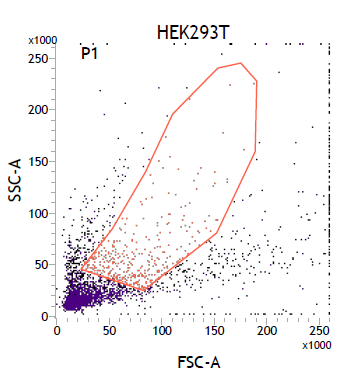
2. PI-A vs PI-W的點狀圖
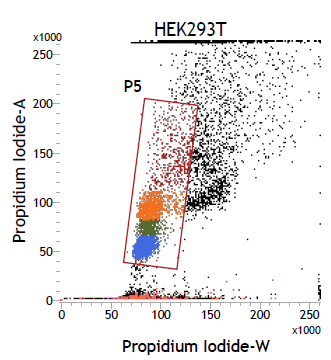
3. PI 的一維線性圖
細胞週期分析樣本前處理流程
樣本請依照以下步驟進行固定
1. 細胞至少種2x106/mL。
*細胞培養時,細胞密度不可超過九成滿,過高的細胞密度可能造成細胞週期的變異。
2. 收集細胞懸浮液至 15 mL tube
(通常以0.05% Trypsin收集細胞,若特殊細胞以平常繼代方式將細胞收集至15 mL離心管中)
3. 離心1500 rpm, 5 min, 4˚C;離心後去除上清液。
4. 以 1X sterile PBS,3 mL/tube清洗細胞。
5. 重複3.、4.步驟兩次。
6. 離心 1500 rpm, 5 min, 4˚C,去除上清液。
7. 緩慢滴入 1 mL 75% 冰乙醇,滴入同時進行Vortex 避免細胞結塊,此步驟用以固定細胞及細胞膜穿孔。
*75% 乙醇以ddH2O配置。請勿用PBS配置,會造成細胞結塊。
*75% 冰乙醇滴入細胞時,要一邊滴一邊vortex,避免細胞結塊。
*避免大力搖晃離心管,以免造成細胞破裂
8. 冰乙醇滴完後可於 4 ˚C保存。
9. 細胞樣本完整性確認。用 1x PBS 980 μL稀釋20 μL的細胞懸浮液,以光學顯微鏡觀察細胞完整性。
.png)
填寫 細胞週期分析服務委託書
或
電話 : 03-2870051
email : order@acebiolab.com

.png)